植物细胞自噬是一种通过脂膜包裹自身细胞质蛋白或细胞器,并将其运送到液泡降解的过程,藉此循环利用细胞内的生物大分子,从而维持营养能量的持续供给。植物在营养能量缺乏时诱导自噬发生,这个过程时刻受到一系列不同的自噬相关 (AuTophaGy-related, ATG) 蛋白的高度调控。前人的研究表明,植物的营养状况是由蔗糖非酵解型蛋白激酶 (SNF1-related protein kinase, SnRK1) 和雷帕霉素靶蛋白 (target of rapamycin, TOR) 激酶共同负责感知,并把相关信号传递给自噬途径上游的ATG1蛋白激酶复合体,后者相应地激活或抑制自噬。因而,依赖于ATG1蛋白激酶复合体的途径一直被视为经典自噬途径。
与该经典自噬途径不同,华南农业大学生命科学学院李发强教授团队近期发现了一种新的不依赖于ATG1蛋白激酶复合体的植物细胞自噬途径。相关研究结果以Genetic Analyses of the Arabidopsis ATG1 Kinase Complex Reveal Both Kinase-Dependent and Independent Autophagic Routes during Fixed-Carbon Starvation为题发表在The Plant Cell 上。值得一提的是,The Plant Cell 同时刊发了题为You Are What You Eat: An ATG1-Independent Path to Autophagy的文章,对该研究成果进行了介绍。


该研究通过遗传学和细胞生物学分析表明,在植物中,ATG1蛋白激酶复合体的调节亚基ATG13和骨架蛋白ATG11仅为缺氮或短期缺碳条件下诱导的自噬途径所必需,而不为长期缺碳条件下的自噬发生所必需。也就是说,植物在长期缺碳条件下发生的自噬可能以一种不依赖于ATG1蛋白激酶复合体的方式被激活。为验证这个假说,该研究首先在拟南芥中构建了ATG1的四突变体 (atg1abct),发现该突变体与atg11和atg13突变体类似,具有早衰和对氮饥饿敏感的表型,但是它对碳饥饿的敏感程度不如影响自噬途径下游的atg5-1 和atg7-2的突变体(图1)。该团队继而通过细胞生物学和免疫分析的研究,证明了植物中的确存在着一条独立于ATG1蛋白激酶复合体介导的自噬途径。

图1. atg1abct 四突的表型。
通过进一步的遗传学和药物处理分析,该团队发现负责细胞自噬囊泡形成时膜运输的ATG2/9/18复合体也不为长期缺碳条件下诱导的自噬途径所必需,但施加磷脂酰肌醇3-激酶 (phosphatidylinositol 3-kinase, PI3K) 的抑制剂可以抑制该途径的激活;后续研究发现是SnRK1,而不是TOR激酶的活性参与了该途径的调控。由此该团队推导出一个新的自噬途径模型(图2):在这种不依赖于ATG1蛋白激酶复合体的自噬途径中,SnRK1扮演了感知植物营养状况的角色,绕过了ATG1蛋白激酶复合体,通过直接磷酸化PI3K复合体来激活细胞自噬。该团队随后的研究结果支持了这一模型,即SnRK1的KIN10亚基能直接磷酸化PI3K复合体中的ATG6。并且,在ATG1蛋白激酶复合体缺席时,KIN10的过表达激活了ATG6的磷酸化,并加速了长期缺碳条件下的自噬进程。基因敲减KIN10则呈现出相反的效应。
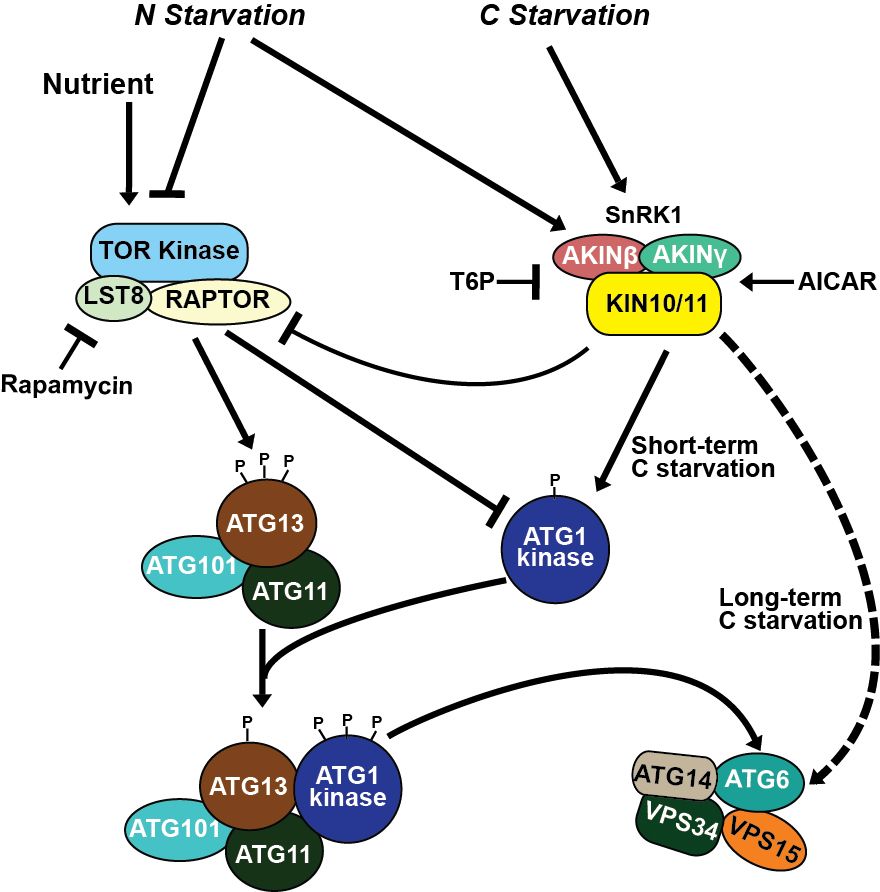
图2. 不依赖于ATG1蛋白激酶复合体的自噬途径。
这一研究工作首次揭示了缺碳条件下植物中存在两条各自独立的自噬途径:依赖于和不依赖于ATG1蛋白激酶复合体的途径。进一步剖析不依赖于ATG1蛋白激酶复合体的这一自噬新途径,将为提高植物的抗逆性和提高作物产量提供新思路。
该论文第一署名单位为华南农业大学,华南农业大学生命科学学院黄晓博士为第一作者;华南农业大学生命科学学院李发强教授和华盛顿大学圣路易斯分校生物系Richard D. Vierstra教授为该论文的共同通讯作者;华南师范大学高彩吉教授、中山大学肖仕教授、华南农业大学田江教授、威斯康星大学麦迪逊分校Marisa Otegui教授及国立釜山大学Taijoon Chung教授作为共同作者,为该研究的实施提供了必要的技术支持。该研究工作得到了国家自然科学基金、广东省自然科学基金和华南农业大学引进人才科研启动基金的支持。
论文链接:http://www.plantcell.org/content/early/2019/10/15/tpc.19.00066
