
iPlants,专注植物最前沿。更多前沿研究,请关注我们!
前言:
肌动蛋白是植物,哺乳动物和其他真核细胞中最丰富,最保守的蛋白质之一,它们形成丝状结构,在关键的细胞过程中发挥重要作用。尽管已经积累了大量有关植物肌动蛋白丝的生化活性,动力学行为和重要细胞功能的数据,但其结构基础仍然难以捉摸。。2019年10月19日,国际权威学术期刊The Plant Cell在线发表了北京师范大学任海云研究组与中科院生物物理所孙飞课题组合作题为“Cryo-EM Structure of Actin Filaments from Zea mays Pollen”的研究论文。该研究使用低温冷冻电子显微镜首次报道了玉米花粉中植物肌动蛋白丝(ZMPA)的3.9?结构。

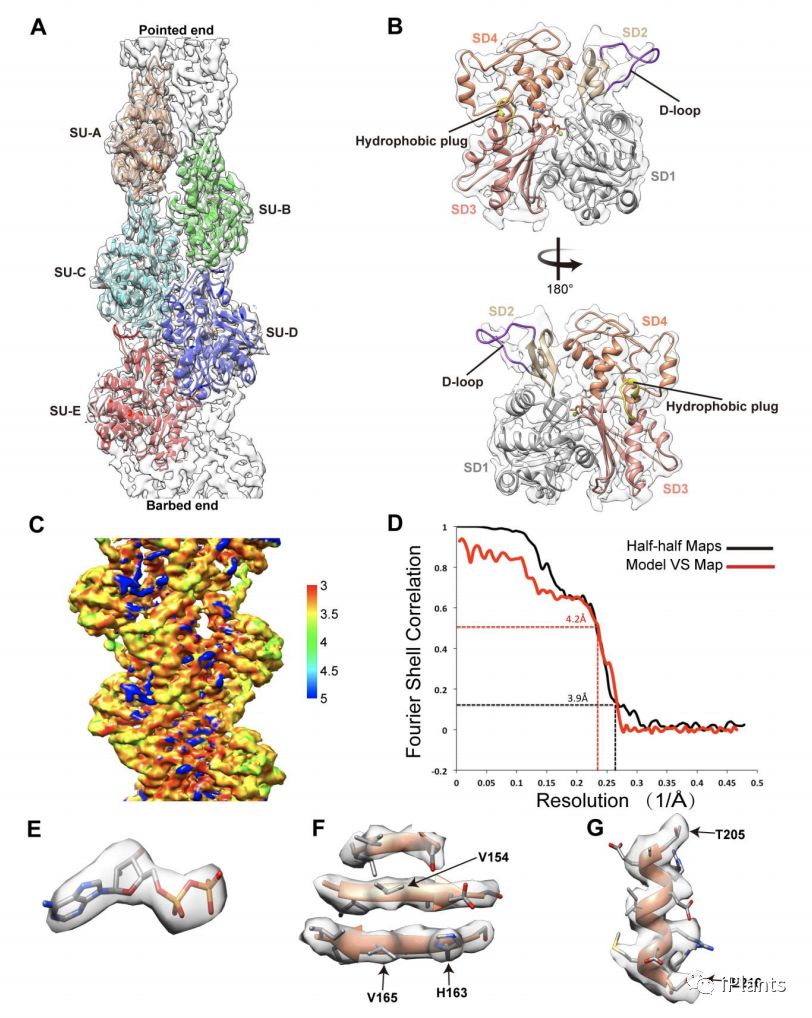
肌动蛋白的细胞骨架在许多基本过程中起着至关重要的作用,包括囊泡和细胞器运输,胞吞和胞吐作用以及细胞分裂和生长。肌动蛋白在体内以两种状态存在:球形肌动蛋白(G-actin)和丝状肌动蛋白(F-actin),它们会动态地发生聚合和解聚的平衡。在大多数情况下,F-肌动蛋白是肌动蛋白的功能形式。因此,研究F-肌动蛋白的结构对于理解其功能机制特别重要。尽管动植物肌动蛋白之间具有高度的蛋白质序列同一性(Kandasamy等人,2012),但它们的生化活性和细胞功能却有所不同(。但是,解释这些差异的结构基础仍然知之甚少,主要是因为尚未解决任何植物F-肌动蛋白的结构。
该研究通过低温冷冻电镜测定的玉米花粉肌动蛋白(ZMPA)细丝的3.9埃分辨率结构,并通过单分子磁镊子测量肌动蛋白细丝的断裂力。该结构显示了一个右手,平行和交错的架构,该架构通过链内和链间的交互作用得以稳定。虽然其总体结构类似于其他肌动蛋白丝的结构,但其DNase I结合环(D环)进一步向外弯曲,采用了与Jasplakinolide或BeFx稳定的兔骨骼肌肌动蛋白(RSMA)丝相似的开放构象。单分子镊子分析表明,ZMPA丝比RSMA丝具有更大的拉伸力。总体而言,这些数据提供了证据表明植物肌动蛋白丝比动物肌动蛋白丝具有更高的稳定性,这对于它们作为长距离囊泡和细胞器运输的轨迹至关重要。
论文链接:http://www.plantcell.org/content/early/2019/10/18/tpc.18.00973
微信加群
iPlants专注于植物科学前沿研究报道,已有近十万学者关注,现组建了15个植物科学研究研究生/教授交流群。欢迎从事植物科学相关研究的同学和老师加入我们,一起讨论学术和梦想。温馨提示:进群请备注一下(格式如学校+专业+姓名,如果是PI/教授,请注明是PI/教授/副教授/副研究员/博后,否则就直接默认为在读研究生,谢谢)。加小编微信号(ID: iplants123)或长按下面二维码时,请注明学校和专业,否则不予通过。

iPlants,专注植物最前沿。投稿、商务合作、转载开白名单等事宜请联系微信ID:
iplants123 或邮箱:703131029@qq.com